¿Qué es la sal de Berthollet? Sal de Berthollet: propiedades químicas, preparación y uso.
Los procesos reales durante la electrólisis de una solución de cloruro de potasio o sodio son más complejos. El hipoclorito (clorato) se puede formar por oxidación directa del anión cloruro o por la reacción del cloro (que se forma en el ánodo) con un álcali (ver. Bakhchisaraitsyan N. G. et al. Taller sobre electroquímica aplicada (1990)- pág. 179 y siguientes)
Los ánodos de grafito usados, así como los lodos anódicos, contienen trazas de compuestos clorados altamente tóxicos (incluidas dioxinas). Una pequeña cantidad de material proveniente de una instalación de laboratorio no representa un peligro significativo. Sin embargo, se debe evitar el contacto directo del material de desecho con la piel. Como referencia: el primer caso documentado de cloracné (lesiones cutáneas por dioxinas) se observó entre trabajadores de la producción de cloro en Alemania que trabajaban con lodos anódicos.
6. En la versión presentada del electrolizador, el ánodo relativamente caro se utiliza de manera ineficaz, ya que casi toda la corriente fluye sólo a través de la parte de su superficie que mira hacia el cátodo. Si realiza cambios menores en el diseño fijando el ánodo en el centro del contenedor y hace un cátodo económico a partir de varios elementos ubicados a distancias iguales alrededor del ánodo, puede reducir significativamente el desgaste del ánodo reduciendo la densidad de corriente ( alternativamente, acelerar el proceso aumentando la corriente al mismo tiempo que su densidad anódica).
La conexión en serie de electrolizadores permite un uso eficiente de la potencia de la fuente de energía, cuyo voltaje es significativamente mayor que el requerido para una celda. Sin embargo, este diseño también tiene un inconveniente importante: si bien la corriente es la misma para cada celda, incluida la celda con la mayor resistencia, la caída de voltaje en esta celda "mala" será mayor que en cualquier otra. Como resultado, la potencia disipada por una celda "defectuosa" puede hacer que se sobrecaliente, lo que a su vez acelerará el desgaste del ánodo. Como resultado del desgaste, la resistencia de una celda "defectuosa" puede aumentar aún más, la caída de voltaje a través de ella aumentará, lo que provocará una mayor degradación.
Dado que un aumento en la resistencia total provocará una disminución general de la corriente, el rendimiento de todas las celdas disminuirá simultáneamente. Si se utiliza una fuente de energía con un sistema de estabilización actual, la celda "mala" se destruirá rápidamente.
Por lo tanto, cuando se conectan en serie, todos los electrolizadores deben tener un diseño lo más parecido posible y estar en las mismas condiciones. Esto no siempre es fácil de lograr en el laboratorio. Por esta razón, se recomienda no cargar los electrolizadores cerca del límite en términos de parámetros básicos, principalmente densidad de corriente y temperatura.
7. El trolebús dispone de colectores de corriente (pantógrafos) equipados con inserciones de grafito, que garantizan el deslizamiento a lo largo de los cables y un contacto continuo.
Estas escobillas de contacto se desgastan y arden formando arcos si el contacto no tiene éxito. De vez en cuando, los conductores los reemplazan por otros nuevos y tiran los viejos al costado de la carretera. En las últimas paradas hay especialmente muchos cepillos usados. Puedes caminar y recolectar suficiente para experimentos de electroquímica.
Hice estos electrodos a partir de contactos de trolebús.
Los electrodos se cortan del inserto de grafito de un colector de corriente de trolebús con un pasador portador de corriente atornillado en una rosca M3. También es un elemento de sujeción de los electrodos en el electrolizador.
Las clavijas y los lugares donde están incrustadas en los electrodos están recubiertos con barniz de cloruro de polivinilo para protegerlos contra la corrosión.
El nombre científico de la sal de bertolita es clorato de potasio. Esta sustancia tiene la fórmula KClO3. El clorato de potasio fue obtenido por primera vez por el químico francés Claude Louis Berthollet en 1786. Berthollet decidió pasar cloro a la solución calentada. Cuando la solución se enfrió, cristales de clorato de potasio cayeron al fondo del matraz.
Cloruro de potasio
La sal de Berthollet son cristales incoloros que se descomponen cuando se calientan. Primero, el clorato de potasio se descompone en perclorato y cloruro de potasio y, con un mayor calentamiento, el perclorato de potasio se descompone en cloruro de potasio y oxígeno.
Es de destacar que la adición de catalizadores (óxidos de manganeso, cobre, hierro) a la sal de Berthollet reduce varias veces su temperatura de descomposición.
Uso de la sal de Berthollet
Otro método industrial para producir sal de bertolita es la electrólisis de soluciones acuosas de cloruro de potasio. Primero se forma una mezcla de hidróxido de potasio y cloro en los electrodos, luego a partir de ellos se forma hipoclorito de potasio, del que finalmente se obtiene la sal de Berthollet.
Claude Berthollet
El inventor del clorato de potasio, Claude Berthollet, fue médico y farmacéutico. En su tiempo libre se dedicaba a experimentos químicos. Claude logró un gran éxito científico: en 1794 fue nombrado profesor en dos escuelas secundarias de París.
Berthollet se convirtió en el primer químico que logró establecer la composición del amoníaco, el sulfuro de hidrógeno, el gas de los pantanos y el ácido cianhídrico. Inventó el fulminato de plata y el proceso de blanqueo con cloro.
Posteriormente, Berthollet trabajó en cuestiones de defensa nacional y se desempeñó como asesor de Napoleón. Al final de su servicio, Claude fundó un círculo científico, que incluía a científicos franceses tan famosos como Gay-Lussac, Laplace y Humboldt.
Introducción
Mientras estudiabas el oxígeno en química, llegaste a la sección “Producción de oxígeno en el laboratorio mediante la descomposición de sustancias inorgánicas”. "La descomposición del agua, el permanganato de potasio, el peróxido de hidrógeno, los óxidos pesados y los nitratos de metales activos... entonces, todo parece estar claro. ¿Obtener oxígeno a partir de la sal de bertolita? ¡¿Qué clase de animal es este?!" - la línea de pensamiento estándar de cada estudiante que ve este párrafo en el libro de texto. No enseñan sal de porcelana en la escuela, así que tienes que preguntar tú mismo al respecto. Hoy en este artículo intentaré responder con el mayor detalle posible a la pregunta de qué es la sal de Bertholet.
origen del nombre
Primero, hablemos de su nombre. La sal es una clase separada de sustancias inorgánicas, cuya fórmula química tiene la siguiente disposición de elementos: Me-n- residuo ácido, donde Me es un metal, residuo ácido es un residuo ácido, n es el número de átomos (puede no estar presente si la valencia del metal es la misma y el residuo ácido es el mismo). El residuo ácido se toma de cualquier ácido inorgánico. La fórmula química de esta sal es KClO 3. El metal presente en él es potasio, lo que significa que es potasio. La fuente del residuo de ClO 3 es el ácido perclórico HClO 3 . En total, la sal de Bertholet es la sal potásica del ácido perclórico. También se le llama clorato de potasio, y se le atribuye el adjetivo “bertoletova” por el nombre de su descubridora.
Historia del descubrimiento
Fue obtenido por primera vez en 1786 por el químico francés Claude Berthollet. Pasó cloro a través de una solución concentrada y caliente de hidróxido de potasio (foto).

Sal de Bertholet: obtención
La producción industrial de cloratos (incluida la sal de Berthollet) se basa en la reacción de desproporción de los hipocloritos, que se obtienen por interacción del cloro con soluciones alcalinas. El diseño del proceso puede ser diferente: debido a que el producto de mayor tonelaje es el hipoclorito de calcio, a partir del cual se elabora la lejía, el proceso más común es la implementación de una reacción de intercambio entre clorato de calcio (se obtiene calentando hipoclorito de calcio) y cloruro de potasio (cristaliza en las aguas madres). El clorato de potasio también se puede obtener utilizando un método de Berthollet modificado mediante electrólisis del cloruro de potasio sin diafragma. El cloro resultante y el hidróxido de potasio reaccionan inmediatamente. El producto de su reacción es hipoclorito de potasio, que se desproporciona aún más en cloruro de potasio y clorato de potasio originales.
Propiedades químicas

Si la temperatura de calentamiento alcanza los 400 o C, se produce la descomposición de la sal de bertolita, durante la cual se libera oxígeno y se forma intermediamente perclorato de potasio. Con catalizadores (óxido de manganeso (4), óxido de hierro (3), óxido de cobre, etc.), la temperatura a la que se produce este proceso se vuelve mucho menor. La sal de Berthollet y el sulfato de amonio pueden reaccionar en una solución acuosa de alcohol y formar clorato de amonio.
Solicitud
Las mezclas de agentes reductores (fósforo, azufre, compuestos orgánicos) y clorato de potasio son explosivas y sensibles a los golpes y la fricción (foto de arriba). La sensibilidad aumenta si hay bromatos y sales de amonio presentes. Debido a su alta sensibilidad, las composiciones que contienen sal de Berthollet casi nunca se utilizan en la producción de explosivos militares e industriales. A veces se utiliza en pirotecnia como fuente de cloro para composiciones con llamas de colores.

También se encuentra en cabezas de cerillas y muy raramente puede ser un iniciador de explosivos (el polvo de clorato detonaba la cuerda y era la composición de las granadas de mano de la Wehrmacht). Y en la URSS, el clorato de potasio se incluye en la mecha de los cócteles Molotov preparados según una receta especial. Las soluciones de sal de Berthollet se utilizaban anteriormente a veces como antiséptico suave y para hacer gárgaras medicinales externas. A principios del siglo XX se utilizaba la sal de bertolita para producir oxígeno en el laboratorio. Sin embargo, debido a su alto peligro, dejó de utilizarse. También se utiliza para obtener dióxido de cloro en el laboratorio (se realiza la reacción de reducción del clorato oxalato de potasio y se añade ácido sulfúrico).
Conclusión
Ahora ya sabes todo sobre la sal de porcelana. Puede resultar útil y extremadamente peligroso para los humanos. Si tienes cerillas en casa, cada día observarás una de las aplicaciones de la sal de Berthollet en la vida cotidiana.
Introducción
Mientras estudiabas el oxígeno en química, llegaste a la sección “Producción de oxígeno en el laboratorio mediante la descomposición de sustancias inorgánicas”. "La descomposición del agua, el permanganato de potasio, el peróxido de hidrógeno, los óxidos pesados y los nitratos de metales activos... entonces, todo parece estar claro. ¿Obtener oxígeno a partir de la sal de bertolita? ¡¿Qué clase de animal es este?!" - la línea de pensamiento estándar de cada estudiante que ve este párrafo en el libro de texto. No enseñan sal de porcelana en la escuela, así que tienes que preguntar tú mismo al respecto. Hoy en este artículo intentaré responder con el mayor detalle posible a la pregunta de qué es la sal de Bertholet.
origen del nombre
Primero, hablemos de su nombre. la sal está separada clase de sustancias inorgánicas, en cuya fórmula química existe la siguiente disposición de elementos: Me-n- residuo ácido, donde Me es un metal, residuo ácido es un residuo ácido, n es el número de átomos (puede no estar presente si la valencia del metal y el residuo ácido es el mismo). El residuo ácido se toma de cualquier ácido inorgánico. La fórmula química de esta sal es KClO 3. El metal presente en él es potasio, lo que significa que es potasio. La fuente del residuo de ClO 3 es el ácido perclórico HClO 3 . En total, la sal de Bertholet es la sal potásica del ácido perclórico. También se le llama clorato de potasio, y se le atribuye el adjetivo “bertoletova” por el nombre de su descubridora.
Historia del descubrimiento
Fue obtenido por primera vez en 1786 por el químico francés Claude Berthollet. Pasó cloro a través de una solución concentrada y caliente de hidróxido de potasio (foto).

Sal de Bertholet: obtención
La producción industrial de cloratos (incluida la sal de Berthollet) se basa en la reacción de desproporción de los hipocloritos, que se obtienen por interacción del cloro con soluciones alcalinas. El diseño del proceso puede ser diferente: debido a que el producto de mayor tonelaje es hipoclorito de calcio, De la que se elabora la lejía, el proceso más común es realizar una reacción de intercambio entre el clorato de calcio (se obtiene calentando hipoclorito de calcio) y el cloruro de potasio (cristaliza en las aguas madres). El clorato de potasio también se puede obtener utilizando un método de Berthollet modificado mediante electrólisis del cloruro de potasio sin diafragma. El cloro resultante y el hidróxido de potasio reaccionan inmediatamente. El producto de su reacción es hipoclorito de potasio, que es aún más desproporcionado con respecto al original. cloruro de potasio y clorato de potasio.
Propiedades químicas

Si la temperatura de calentamiento alcanza los 400 o C, se produce la descomposición de la sal de bertolita, durante la cual se libera oxígeno y se forma intermediamente perclorato de potasio. Con catalizadores (óxido de manganeso (4), óxido de hierro (3), óxido de cobre, etc.), la temperatura a la que se produce este proceso se vuelve mucho menor. La sal de Berthollet y el sulfato de amonio pueden reaccionar en una solución acuosa de alcohol y formar clorato de amonio.
Solicitud
Mezclas de agentes reductores (fósforo, azufre, compuestos orgánicos) y el clorato de potasio son explosivos y sensibles a los golpes y la fricción (foto de arriba). La sensibilidad aumenta si hay bromatos y sales de amonio presentes. Debido a su alta sensibilidad, las composiciones que contienen sal de Berthollet casi nunca se utilizan en la producción de explosivos militares e industriales. A veces se utiliza en pirotecnia como fuente de cloro para composiciones con llamas de colores.

También se encuentra en cabezas de cerillas y muy raramente puede ser un iniciador explosivo (el polvo de clorato detonaba la cuerda y era la composición de las granadas de mano de la Wehrmacht). Y en la URSS, el clorato de potasio se incluye en la mecha de los cócteles Molotov preparados según una receta especial. Las soluciones de sal de Berthollet se utilizaban anteriormente a veces como antiséptico suave y para hacer gárgaras medicinales externas. A principios del siglo XX se utilizaba la sal de bertolita para producir oxígeno en el laboratorio. Sin embargo, debido a su alto peligro, dejó de utilizarse. Además, utilizándolo en condiciones de laboratorio, se obtiene dióxido de cloro (realizan la reacción de reducción de clorato de potasio con ácido oxálico y añaden ácido sulfúrico).
Conclusión
Ahora ya sabes todo sobre la sal de porcelana. Puede resultar útil y extremadamente peligroso para los humanos. Si tienes cerillas en casa, cada día observarás una de las aplicaciones de la sal de Berthollet en la vida cotidiana.
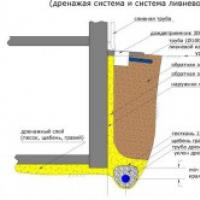 Precio del drenaje de cimientos de pared Materiales y herramientas.
Precio del drenaje de cimientos de pared Materiales y herramientas. Distancia entre el pozo y el pozo negro: estándares SanPiN y SNiP Pozo negro en un edificio de apartamentos
Distancia entre el pozo y el pozo negro: estándares SanPiN y SNiP Pozo negro en un edificio de apartamentos Instalación de la lavadora y conexión al suministro de agua.
Instalación de la lavadora y conexión al suministro de agua. Ajustar el termostato del frigorífico con sus propias manos Termostato casero para frigorífico utilizando elementos discretos
Ajustar el termostato del frigorífico con sus propias manos Termostato casero para frigorífico utilizando elementos discretos Barbacoa: ahumadero de bricolaje con cilindros de gas Ahumadero de bricolaje con cilindro de propano
Barbacoa: ahumadero de bricolaje con cilindros de gas Ahumadero de bricolaje con cilindro de propano Velomóvil para niños de bricolaje: descripción detallada y diagrama
Velomóvil para niños de bricolaje: descripción detallada y diagrama Métodos para soldar alambres de cobre Soldadura por puntos de alambres de cobre.
Métodos para soldar alambres de cobre Soldadura por puntos de alambres de cobre.